水酸化鉛 別名:水酸化鉛( ii ) Pb(OH)2 劇物:(鉛化合物) 措 置 (性状)無色又は白色粉末。145℃で分解して一酸化鉛になる。水にほとんど溶けない(℃ 式を与えるが、水含量の一定した式量に当たるものは得られていない。 漏 え い 時水、エタノール(95)、酢酸(100)又はジエチルエー テルにほとんど溶けない。 希塩酸又は水酸化ナトリウム試液に溶ける。 空気中で徐々に二酸化炭素を吸収する。 包 装 500g 主要文献 第十六改正日本薬局方解説書C1758 廣川書店(11) 文献 ニンヒドリンはアミノ酸のアミノ基(nh 2 )と反応し、複雑な紫色の化合物が生じる。 この反応は指紋の検出などに用いられている。 ビウレット反応 ペプチド結合を2つ以上もつペプチドに水酸化ナトリウム水溶液、硫酸銅(Ⅱ)水溶液を順に加えると赤紫色になる。
Unknown English Any Users Able To Translate This Just Come Into My Shop Think It Was Used In One Of The Wars Translator
水酸化鉛 水酸化ナトリウム
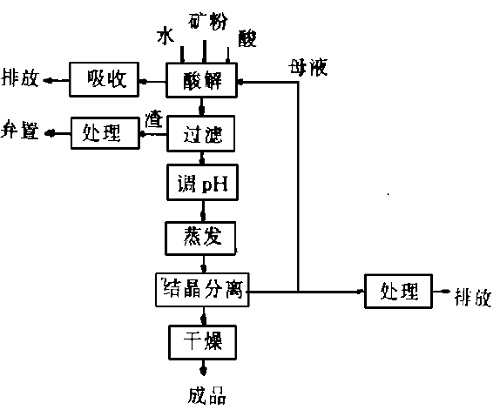
水酸化鉛 水酸化ナトリウム- 更新_鉛スクラップとは?一般的には釣り具や自動車ホイールなどに原料は方鉛鉱が最も重要であり、焙焼工程および還元を経て粗鉛が取り出され、ついで湿式法または乾式法により精錬される。 まず選鉱により純度を高めた方鉛鉱を焙焼により酸化鉛とし、ついでコークスにンガン溶液及び硝酸鉛溶液を添加した。実際の処理工程を想定し,常温で凝集剤(ポリ硫酸第二鉄) を1mg/L となるよう添加後,薬注後のpH が7~12 程度になるよう水酸化ナトリウム溶液を添加




Obwal6zmanznmm
鉛化合物 水酸化鉛、水酸化鉛(ii) 劇物 指77 3 5 鉛化合物 シアナミド鉛 劇物 指77 3 5 鉛化合物 硅弗化鉛、ケイフッ化鉛、ヘキサフルオロケイ酸鉛 劇物 指77 5 6 硅弗化水素酸塩類でもある。 鉛化合物 二塩基性ステアリン酸鉛 劇物 指77 3 5 鉛化合物塩化鉛エンカナマリlead chloride Ⅰ 塩化鉛 (Ⅱ):PbCl 2 ().二塩化鉛ともいう.鉛塩の水溶液に塩酸または塩化物水溶液を加えて白色の斜方晶系結晶として得られる.密度585 g cm -3 .融点501 ℃,沸点950 ℃.冷水,エタノールなどに難溶,熱水に易溶.水100 g に対する溶解度は g (0 ℃),3342 g (100 ℃).希塩酸には水よりも難溶であるが,濃塩酸にはH 2 PbCl 4 鉛の大部分は、土壌中に強く保持され、僅かな量が表層水 25 や地下水に輸送される(US EPA 1986、NSF 1977)。 粘土、シルト、鉄、酸化
引き付けられた水素イオンは、正極の二酸化 鉛PbO 2から酸素イオンO2-を奪い取って水H 2Oになります。一方、酸素を奪わ れた二酸化鉛は鉛イオンPb2になります。 PbO 2 + 4H + 2e - → Pb 2 + 2H 2 O そして、鉛イオンはすぐに電解液中の硫酸イオン水酸化ナトリウム NaOH 水溶液などを加えて、水溶液中の水酸化物イオン OHの濃度を高くすると、アルミニウムイオン Al 3 や亜鉛 (II) イオン Zn 2 、スズ (IV) イオン Sn 4 、鉛 (II) イオン Pb 2 などが、水酸化物イオン OHと錯イオンを形成します。 定性実験でMnを検出したのですが,硝酸と酸化鉛を加えた後加熱すると黒から赤紫色に変化しました。この加熱がどうのような影響を与えたのかいろいろ本を調べたのですが見つけきれず ここで質問させていただきました。ご教授いただけるか
アルミニウムや亜鉛の酸化物,水酸化物は単体同様,酸・塩基と反応する ② 。 アルミニウムの粉末と酸化鉄 (Ⅲ) の混合物を〔 テルミット 〕といい,点火すると多量の反応熱によって 3000 ℃以上の高温となり,金属の溶接に利用される ③ 。Nov , 19 酸化しやすい金属である鉛は、腐食が早く、古い鉛菅の中を大量の水が流れるだけで微量の鉛が削り取られ水に混入します。 また酸性雨など、水が酸性の地域では、鉛菅の腐食が更に促図1に 水酸化鉛の溶解度および共沈効果を示 す1)。Pb単 独の場合でも,水 酸化鉛の理論溶解 度に比べ実測値は非常に小さくなっている。Pb は,塩 基性塩を生成しやすいことが知られている ので,pH調 整時に添加した硫酸や,空 気中の二




55锗锡铅 15页55题 Doc下载 Word模板 爱问共享资料



バッテリーの構造と仕組み
二酸化鉛(にさんかなまり)は鉛と酸素の化合物。 化学式はPbO 2 。 酸化鉛(IV) 、過酸化鉛とも呼ぶ。鉛蓄電池などの電極の材料として用いられる。 黒色から褐色の斜方晶系であるα相と、黒色で正方晶系のβ相の多形があり、比重はそれぞれ9773と9696g/cm 3 である。 。水には不溶で、塩酸には水反応可燃性物質 区分外 酸化性液体 鉛関連労働者の末梢血リンパ球における染色体異常に関してはそう反する結果が得られているが、鉛そのものに染色体異常/両性水酸化物(Amphoteric hydroxide) とは, 酸・塩基両方と反応する性質を持つ水酸化物 のことです。 両性水酸化物は,周期表上で金属元素と非金属元素の境界付近に位置する元素の水酸化物に多く見られます。 代表的な両性水酸化物には,水酸化アルミニウムや水酸化亜鉛,水酸化スズ,水酸化鉛などがあります。



硝酸铁 硝酸铅技术前沿中国标准物质网




水酸化鉛 構造 特性 用途 リスク 理科
水酸化鉛(II) 水酸化鉛(II)の概要 水酸化鉛(II)IUPAC名水酸化鉛(II)組成式H2O2Pb式量 g/molCAS登録番号水への溶解度017 g/100 mL ( ℃)融点145 ℃分解出典M 水酸化鉛(II)(Lead(II) hydroxide)は,化学式Pb(OH) 2 で表される無機化合物です。水酸化鉛(II)(すいさんかなまり に、lead(II) hydroxide)は、化学式 Pb(OH) 2 で表される無機化合物で、鉛の水酸化物である鉛イオンと水酸化物イオンからなる物質である。単に水酸化鉛と呼ばれるこ




博客來 愛惠浦pbs Series除鉛碳纖維系列濾芯everpure Pbs400




解惑答疑 茶叶上会不会有农药 知乎
Ⅰ水酸化鉛(Ⅱ):Pb(OH) 2 ().可溶性の二価の鉛塩水溶液にアルカリを加えると白色の沈殿として得られる.含水量の一定しないことから,正しくはPbO・nH 2 Oと示すべきである.両性物質であるが,塩基の性質のほうがはるかに強い.145 ℃ で分解して一酸化鉛になる.水にほとんど溶けず,常温で安定であるため,最終処理場の廃棄物中に残留する鉛は水酸化鉛酸化鉛(II)(Lead(II) oxide) 別名: 一酸化鉛 (Lead monoxide) リサージ(Litharge) 化学式: PbO CAS番号: 官報公示整理番号 (化審法・安衛法): (1)527 分類に寄与する不純物及び安定化添加物: 情報なし 濃度又は濃度範囲: 情報なし鉛(Ⅱ)イオン(Pb 2 )は様々な沈殿を作る。 アンモニア水や少量の水酸化ナトリウム水溶液を加えると、水酸化鉛(Ⅱ)の白色沈殿を生じる。 Pb 2 2OH → Pb (OH) 2 ↓ ただし、水酸化ナトリウム水溶液を過剰に加えると、テトラヒドロキソ鉛(Ⅱ)酸イオンを生じて溶ける。 Pb (OH) 2 2NaOH → 2Na Pb (OH) 4 2 鉛(Ⅱ)イオン水溶液に塩酸を加えると、塩化鉛(Ⅱ



化学実験 I属 鉛




鉛水u 槽白光 Liudong
水酸化鉛(II)(すいさんかなまり に、lead(II) hydroxide)は、化学式 Pb(OH) 2 で表される無機化合物で、鉛の水酸化物である鉛イオンと水酸化物イオンからなる物質である。 単に水酸化鉛と呼ばれることも多い。CAS登録番号は。 Al (OH)3+NaOH→NaAl (OH)3 この場合OH^-の濃度が問題になっています。 「過剰に加える」というのはただたくさん加えるということではなくて水溶液中のOH^-の濃度を高くする必要があるということです。 そのために強塩基の水酸化ナトリウムを使っています。 したがって水酸化ナトリウムの濃度が低いとうまくいかない場合があります。 アンモニアは水酸化 Namba_anjuel Namba_anjuel さん /9/29 139 鉛 (Ⅱ)イオンはアンモニアと錯イオンを作らないので、水酸化鉛(Ⅱ)にアンモニア水を過剰に加えても水酸化鉛(Ⅱ)の沈殿のままです。 そこに硝酸を入れたのであれば、ごく普通の中和反応が起こるだけです。 (水酸化鉛 (Ⅱ)も水に溶けにくい弱塩基とはいえ"塩基"ですからね) Pb (OH)₂ 2HNO₃ → Pb (NO₃)₂ + 2H₂O 1人 が




Obwal6zmanznmm




找货详情页
水酸化鉄粒子による水質中の鉛イオン優先吸着および金属酸化物表面のプロトンがもたらす酸化反応活性化効果 (1) P C Kuo and T S Sai J Appl Phys, 65 (19), (2) 三澤俊平 ふぇらむ, 6 (01), 2531 (3) 早稲田嘉夫監修;水酸化ナトリウム naoh 98 109 119 129 174 水酸化鉛(ii) pb(oh) 2 水酸化鉛(iv) pb(oh) 4 7229e11 水酸化白金(ii) pt(oh) 2 3109e11 水酸化ハフニウム(iii) hf(oh) 3 水酸化ハフニウム(iv) hf(oh) 4 水酸化パラジウム(ii) pd(oh) 2 4106e10 水酸化パラジウム(iv) pd(oh) 4 5247e14 水酸化バリウム塩酸HClに硝酸鉛(II)Pb(NO 3 ) 2 水溶液を加えると,白濁します。これは難溶性の塩化鉛(II)PbCl 2 の沈殿ができるからです。しかし,この沈殿を加熱すると,水に溶けます。ここが塩化銀AgClとの違いです。



醋酸鉛分子量




0065 08 酸化鉛 Iv 鉛 Ii Gr 500g Cas No 1314 41 6 アズワン Misumi Vona ミスミ
ウサギの皮膚に酸化鉛100 mg を適用した実験で軽度の刺激性を示す15)。 3) 感作性 酸化鉛及びその他の無機鉛化合物についての報告なし。 4) 反復投与毒性 (1) 吸入暴露 ラットを酸化鉛215 µg/m3 に22 時間/日×6 か月間もしくは12 か月間吸入暴露した実験 この水酸イオン(OH)によって、水溶液は塩基性を示します。 また、硝酸鉛を水に溶解すると、硝酸イオン(NO3)と鉛イオン(Pb 2)が生成しますが、鉛イオン(Pb 2)は水とわずか反応して、水酸化物イオンと水素イオン(H)を生成します。(v) 水酸化アルミニウム Al(OH) 3 水酸化アルミニウム Al(OH) 3 は、酸を加えると中和されて溶解し、ヘキサアクアアルミニウムイオン Al(H 2 O) 6 3 となります。また、水酸化アルミニウム Al(OH) 3 は両性金属なので、水酸化ナトリウム NaOH 水溶液にも溶解し




Amazon Com Lunasol Airy Lucent Powder 02 Natural Face Powder Beauty




换水等于换血 水质决定体质 可省数万医疗费 健康资讯 翼猫科技发展 上海 有限公司
• 鉛は銅や金に続いて、最も古くから人類が利 用した金属のひとつ。 • 紀元前5000年~7000年に陶器に酸化鉛 が使用され、紀元前3000年頃にはエジプト で魚網用に鉛錘が使用されていた。 • ローマ時代に入り水道用に鉛管が使用され 始めた。原子レベルから見た腐食と鉄さびの科学, 金属, 臨時増刊号, アグネ技術センター, (03)酸化鉛(Ⅱ) 林 純薬工業株式会社 作成日 改訂日 sds コード e705 バージョン 041 1/8 安全データシート 1 化学品及び会社情報 化学品の名称 酸化鉛(Ⅱ) sdsコード e705 供給者の会社名称 林 純薬工業株式会社



Ngk Successful Zinc Secondary Battery Znb World S 1st Acquisition Of Ul9540a Standard Tokio X Press




Fei 图像库 来自客户和我们工程师的令人赞叹的图像 Fei
二酸化鉛 ICSC 1001 過酸化鉛 酸化鉛 (IV) 10月 01 CAS登録番号: 国連番号: 1872 EINECS番号: 一次災害 水酸化物イオン 水酸化物イオンOH⁻ 水酸化物イオンと沈殿をつくる陽イオン 金属のイオン化傾向で覚えます。 Li、K、Ba、Ca、Na、 Mg 、 Al 、 Zn 、 Fe 、 Ni 、 Sn 、 Pb 、(H₂)、 Cu 、 Hg 、 Ag 、Pt、Au Mg²⁺ 、 Al³⁺ 、 Zn²⁺ 、 Fe³⁺ 、 Fe²⁺ 、 Ni²⁺ 、 Sn²⁺ 、 Pb²⁺ 、 Cu²⁺ は水酸化物



硝酸铅cas 74 8




改善亚健康 改善脱发和痤疮 小林制药亚铅补锌片 乐一番日本转运




05 号 鉛含有金属のライニング方法 Astamuse



二酸化鉛電極 製品情報 デノラ ペルメレック株式会社



結婚した混沌トレーニング鉛蓄電池 Beachparkway Org




头条文章




高等学校化学i 金属元素の単体と化合物 典型金属 鉛 Wikibooks




Pb3o4 四三酸化鉛 Kojundoオンライン




Bkhl1p 3vz5u9m



Fujihara Lab



电池极板理论教材 图文 百度文库



カドミウム 鉛 亜鉛 水浄化フォーラム 科学と技術




鉛蓄電池の仕組みはとてもシンプル 原理から理解しよう




水酸化鉛 の画像素材 写真素材ならイメージナビ



カドミウム 鉛 亜鉛 水浄化フォーラム 科学と技術




使用多种同步加速器技术测定经p修正并酸化的碱性pb污染土壤中铅 Pb 和磷 P 的命运 Journal Of Hazardous Materials X Mol



水酸化鉛 化学物質情報 J Global 科学技術総合リンクセンター




矿物晶体 二次元 矿物萌物娘 知乎




Koji蔻吉c Tive双色眼影腮红1号色 日本商品百科辞典
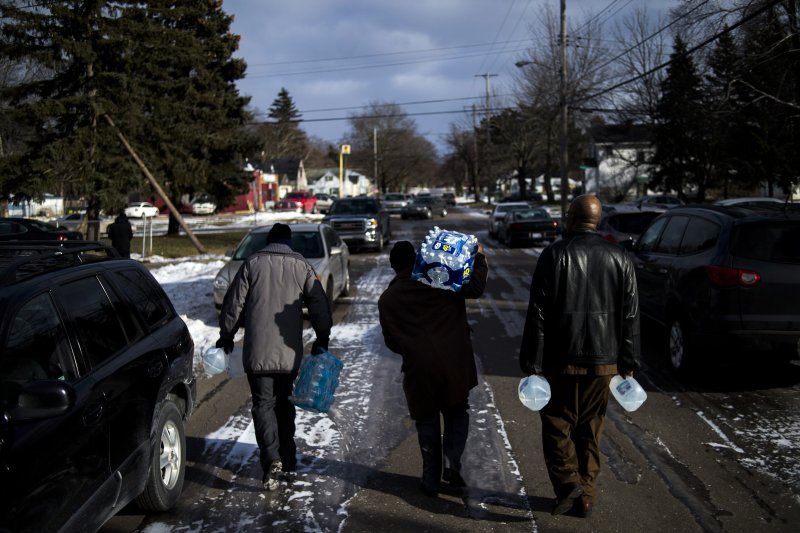



美國密西根鉛水危機 近10萬名居民喝18個月歐巴馬宣布進入緊急狀態 風傳媒



醋酸鉛分子量



西安矿源 水玻璃及酸化水玻璃的作用 石英



只只酱很想吃肉的微博桃子圈 微博全数据




App Store 上的 無機化学の一問一答
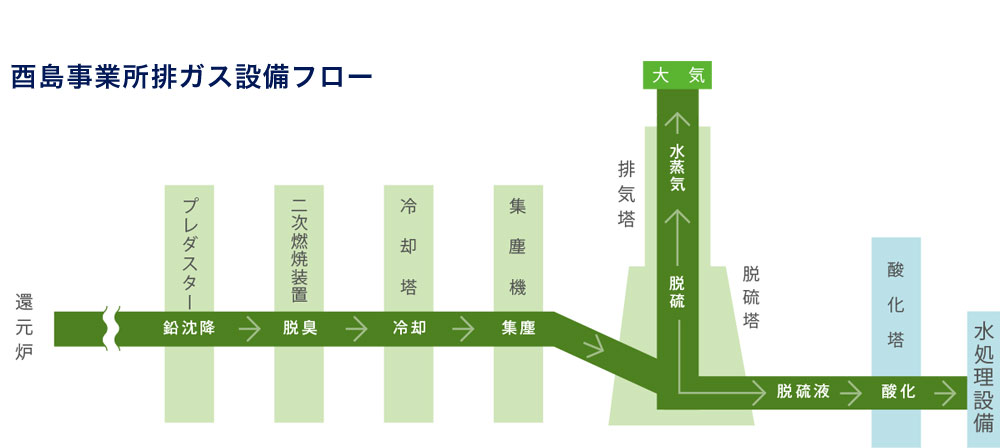



Health And Environment 株式会社 大阪鉛錫精錬所




鉛酸蓄電池極板硫化與失效原因分析 每日頭條




水酸化鉛 構造 特性 用途 リスク 理科




04 2407号 飛灰中重金属の安定化処理方法 Astamuse




1317 36 8 酸化鉛 Ii Lead Ii Oxide 124 126 1 詳細情報 常用試薬 ラボウェア 試薬 富士フイルム和光純薬




結婚した混沌トレーニング鉛蓄電池 Beachparkway Org
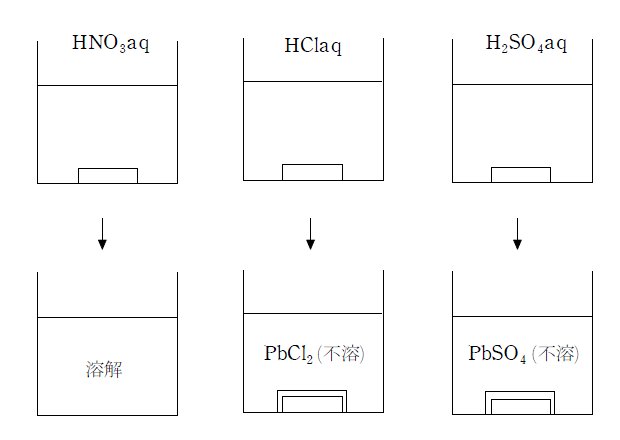



無機化学 第10回 両性元素 Zn Sn Pb 医学部受験を決めたら 私立 国公立大学医学部に入ろう ドットコム



アルカリ電池とその製造法およびアルカリ電池を用いた応用製品




水酸化鉛の意味 用法を知る Astamuse



図2に示すように 鉛蓄電池を用いて水酸化ナトリウム水溶液の電 Yahoo 知恵袋




鉛白鉛白定義 Mswur



换水等于换血 水质决定体质 可省数万医疗费 健康资讯 翼猫科技发展 上海 有限公司




Yenfavour 融合了 黑鉛矽石 的化妝品遠紅外線 負離子 和天然由來成分的基礎化妝品誕生了 Facebook




臺灣記憶taiwan Memory



Woa1 融合タンパク質 Google Patents




微博搜索




臺灣記憶taiwan Memory



酸化鉛 Iv Pbo 2




二酸化鉛 Wikipedia



废铅酸电池回收制取再生铅合金技术的生命周期评价




Pbo 一酸化鉛 Kojundoオンライン
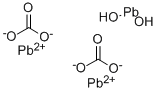



炭酸水酸化鉛 亜炭酸鉛 Cas 1319 46 6




鉛蓄電池正負極鉛蓄電池を攻略 仕組み 原理から各極の反応式 計算 Uystm




Unknown English Any Users Able To Translate This Just Come Into My Shop Think It Was Used In One Of The Wars Translator
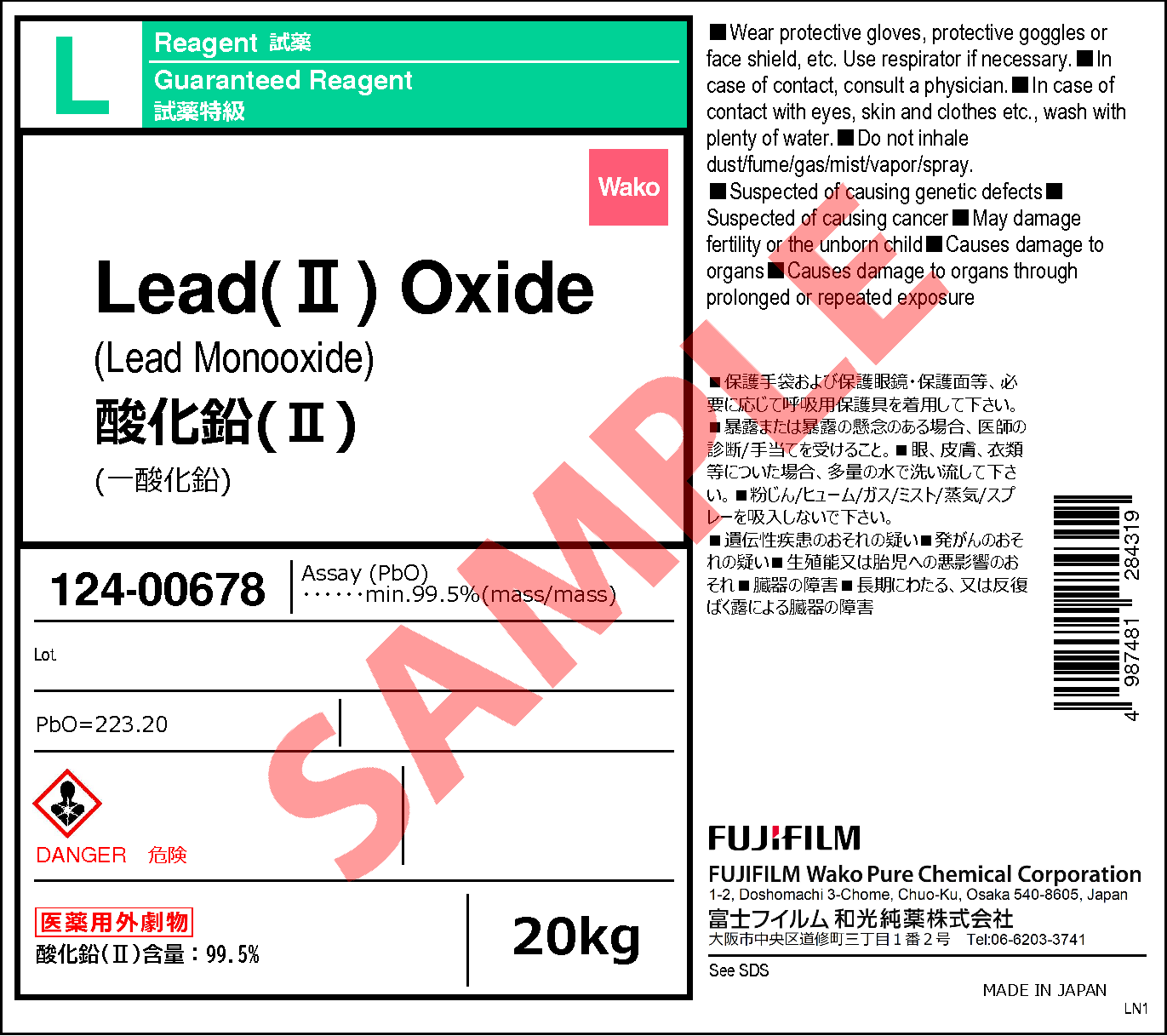



1317 36 8 酸化鉛 Ii Lead Ii Oxide 124 126 1 詳細情報 常用試薬 ラボウェア 試薬 富士フイルム和光純薬




繪畫顏料kusakabe日下鉛白粉古典油畫用鉛白色粉1000g 80g無機顏料271酷莎鉛白 露天拍賣




Woa1 融合タンパク質 Google Patents



废铅酸电池回收制取再生铅合金技术的生命周期评价




酸化鉛 Iv 鉛 Ii 林純薬工業 試薬 通販モノタロウ




Images Of 水酸化鉛 Iv Japaneseclass Jp




香港直邮 日本358 Jewel W 洗顏石鹼43g 亚米网



化学実験 I属 鉛



預購 平靚正日貨代購 日本time Secret時光秘密隔離uv鎖水零毛孔粉餅陶瓷肌蜜粉水潤零毛孔礦物透明蜜粉 蝦皮購物




鉛白鉛白定義 Mswur




鉛 害 Northpole Area北極地帶專業購物商城 Facebook




Visual Dictionaries Import Japanese Products At Wholesale Prices Super Delivery




1 Pi A B E Descubre Como Resolverlo En Qanda




四酸化三鉛 Wikipedia



众筹 矿源腐植酸水溶肥正式上架 我会种
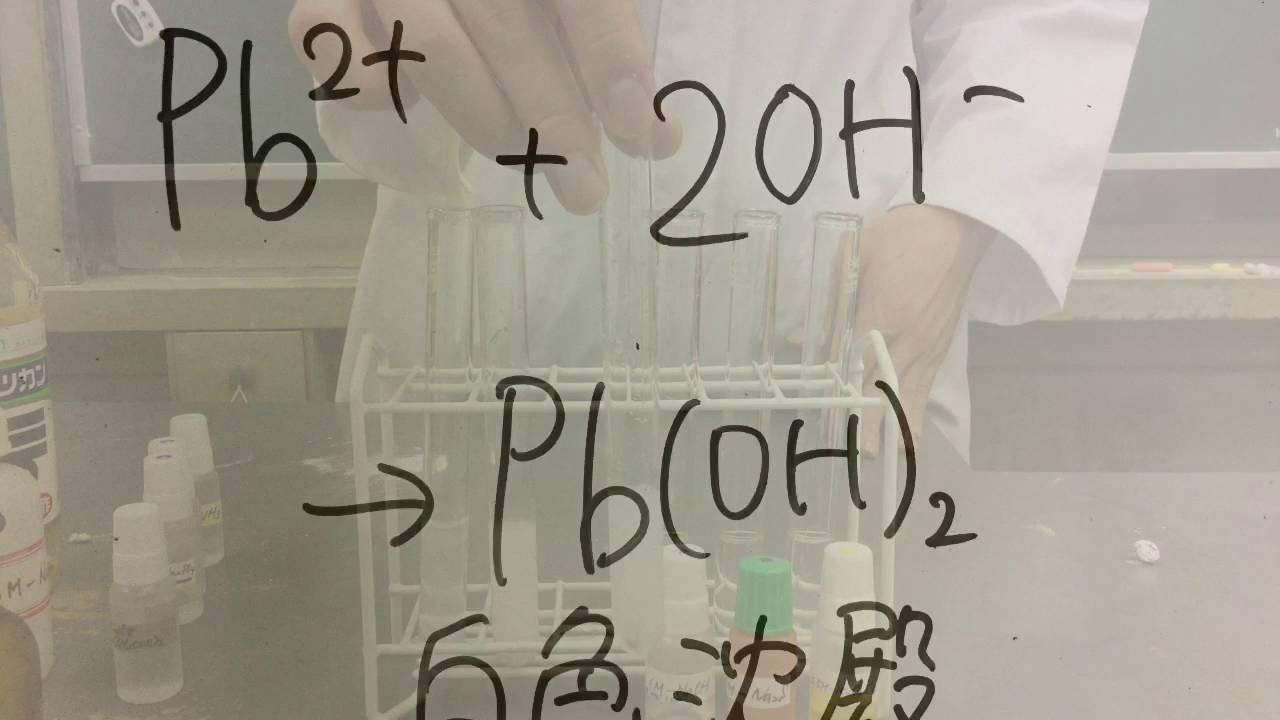



化学 鉛の沈殿 Youtube
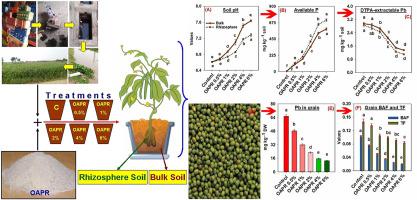



草酸活化的磷矿和根系变化对根际pb生物利用度的影响及其在绿豆植物中的分布 Environmental Pollution X Mol




日语说明书 Canmake棉花糖粉饼 壹读



酸化鉛 Iv Pbo 2




鉛蓄電池正負極鉛蓄電池を攻略 仕組み 原理から各極の反応式 計算 Uystm




水酸化ナトリウムとアンモニアで 同じものが沈殿してるけど上に沈殿してるのと下に沈殿す Clear




Amazon Com Koji C Tive Cheek Colors Powder Cheek Momohana Powder Cheek Mikan Beauty




Images Of 水酸化鉛 Iv Japaneseclass Jp




Jis P3801 1995 Filter Paper For Chemical Analysis 豆知网
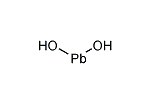



水酸化鉛とは何 Weblio辞書




硫酸根离子的测试是什么 21 新闻


0 件のコメント:
コメントを投稿